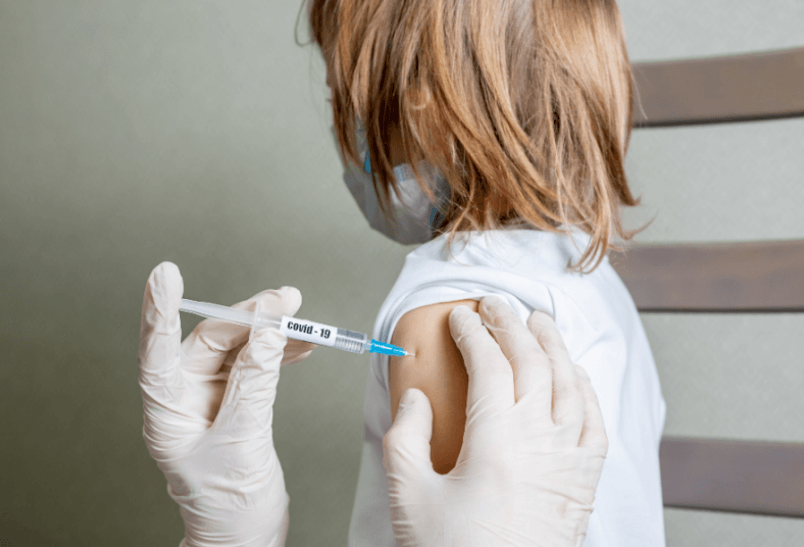
Pfizer i BioNTech: Szczepionki dla dzieci od 5. roku życia są bezpieczne
Pfizer Inc. i BioNTech SE właśnie ogłosiły wyniki badania wykazujące korzystny profil bezpieczeństwa i silne reakcje przeciwciał u dzieci w wieku od 5 do 11 lat. Będzie u nich stosowana zmniejszona dawka preparatu, tzn. około jednej trzeciej ilości podawanej dorosłym w dwóch dawkach w odstępie 21 dni.
- Monika Świetlińska
- /
- 23 września 2021
Będzie pozwolenie na szczepionki dla małych dzieci?
- Dawka 10 µg została starannie dobrana jako dawka preferowana ze względu na bezpieczeństwo, tolerancję i immunogenność u dzieci w wieku od 5 do 11 lat. Są to pierwsze wyniki kluczowego badania szczepionki przeciw COVID-19 w tej grupie wiekowej — poinformowały biura Media Relations Pfizer Inc. i BioNTech SE.
- W ciągu ostatnich dziewięciu miesięcy setki milionów ludzi w wieku 12 lat i starszych z całego świata otrzymały naszą szczepionkę COVID-19. Chcemy rozszerzyć ochronę zapewnianą przez szczepionkę na tę młodszą populację, pod warunkiem uzyskania zezwolenia regulacyjnego, zwłaszcza, że śledzimy rozprzestrzenianie się wariantu Delta i znaczne zagrożenie, jakie stanowi dla dzieci – powiedział Albert Bourla, prezes i dyrektor generalny Pfizer, dodając: - Od lipca liczba pediatrycznych przypadków COVID-19 wzrosła w USA o około 240 procent. Te wyniki badań stanowią mocną podstawę do ubieganie się o zezwolenie na naszą szczepionkę dla dzieci w wieku od 5 do 11 lat i planujemy w trybie pilnym przedłożyć je FDA i innym organom regulacyjnym.
 Niemowlęta do szczepień przeciw covid-19 do końca tego roku? Trwają testyMonika Świetlińska
Niemowlęta do szczepień przeciw covid-19 do końca tego roku? Trwają testyMonika Świetlińska
- Cieszymy się, że możemy przekazać dane organom regulacyjnym dla tej grupy dzieci w wieku szkolnym przed rozpoczęciem sezonu zimowego – powiedział dr Ugur Sahin, dyrektor generalny i współzałożyciel BioNTech, zaznaczając: - Profil bezpieczeństwa i dane dotyczące immunogenności u dzieci w wieku od 5 do 11 lat zaszczepionych mniejszą dawką są zgodne z tymi, które zaobserwowaliśmy w przypadku naszej szczepionki w innych starszych populacjach przy większej dawce.
Pozytywne wyniki badań
Przeprowadzone były badania dotyczące 2268 uczestników w wieku od 5 do 11 lat, którzy otrzymali dawkę 10 µg w schemacie dwudawkowym. Wykazały one silną odpowiedź immunologiczną w tej grupie dzieci miesiąc po podaniu drugiej dawki. Jak podają producenci, szczepionka COVID-19 była dobrze tolerowana, z efektami ubocznymi ogólnie porównywalnymi do tych obserwowanych u uczestników w wieku od 16 do 25 lat.
Pfizer i BioNTech, jak informują oficjalnie, planują jak najszybciej udostępnić te dane amerykańskiej Agencji ds. Żywności i Leków (FDA), Europejskiej Agencji Leków (EMA) i innym organom regulacyjnym. W Stanach Zjednoczonych firmy spodziewają się, że uwzględnią te dane w krótkoterminowym zgłoszeniu o zezwolenie na stosowanie w sytuacjach awaryjnych (EUA), ponieważ nadal gromadzą dane dotyczące bezpieczeństwa i skuteczności wymagane do złożenia wniosku o pełne zatwierdzenie przez FDA w tej grupie wiekowej. Planowana jest również prośba do EMA o aktualizację Warunkowego Pozwolenia na Dopuszczenie do Obrotu w Unii Europejskiej.
 Kto otrzyma trzecią dawkę szczepionki przeciw COVID-19?Martyna Kowalska
Kto otrzyma trzecią dawkę szczepionki przeciw COVID-19?Martyna Kowalska
W czwartym kwartale tego roku planowana jest prezentacja wyników badań dla grup wiekowych 2-5 lat i 6 miesięcy — 2 lata.
Badania skuteczności szczepionek dla niemowląt i dzieci prowadzone są też w Polsce
Jak podały Pfizer Inc. i BioNTech SE do badania włączono około 4500 dzieci w wieku od 6 miesięcy do 11 lat w Stanach Zjednoczonych, Finlandii, Polsce i Hiszpanii z ponad 90 ośrodków badań klinicznych.
W celu oceny bezpieczeństwa, tolerancji i immunogenności szczepionki Pfizer-BioNTech zaprojektowany został schemat dwóch dawek (w odstępie około 21 dni) w trzech grupach wiekowych: w wieku od 5 do 11 lat; wiek od 2 do 5 lat; i wieku od 6 miesięcy do 2 lat. Dzieci 5-11 lat otrzymały dwie dawki po 10 µg każda (dorośli i młodzież przyjmują po 30 µg), dzieci poniżej 5 roku życia — 3 µg na każde wstrzyknięcie w badaniu fazy 2/3. Do badania włączono dzieci z wcześniejszymi dowodami zakażenia SARS-CoV-2 lub bez nich.
Pfizer Inc. i BioNTech SE zastrzegają
- Niniejsza informacja prasowa zawiera wybiegające w przyszłość informacje o wysiłkach firmy Pfizer w walce z COVID-19, współpracy między BioNTech i Pfizer w celu opracowania szczepionki przeciw COVID-19, programie szczepionek mRNA BNT162 oraz COMIRNATY (szczepionka COVID-19, mRNA) (BNT162b2) (...) wiążących się ze znacznym ryzykiem i niepewnością, które mogą spowodować, że rzeczywiste wyniki będą się znacznie różnić od tych wyrażonych lub sugerowanych w takich oświadczeniach. Ryzyka i niepewności obejmują, między innymi, niepewność związaną z badaniami i rozwojem, w tym zdolność do spełnienia przewidywanych klinicznych punktów końcowych, daty rozpoczęcia i/lub zakończenia badań klinicznych, daty składania wniosków przez organy regulacyjne, daty zatwierdzenia przez organy regulacyjne i/lub daty rozpoczęcia, jako a także ryzyko związane z danymi przedklinicznymi i klinicznymi, w tym możliwość uzyskania nowych niekorzystnych danych przedklinicznych, klinicznych lub dotyczących bezpieczeństwa oraz dalszych analiz istniejących danych przedklinicznych, klinicznych lub dotyczących bezpieczeństwa - zastrzegają w informacji prasowej Pfizer Inc. i BioNTech SE.
Dziękujemy, że przeczytałaś/eś nasz artykuł do końca. Jeśli chcesz być na bieżąco z
informacjami prawnymi, zapraszamy do naszego serwisu ponownie!
Jeżeli podobał Ci
się
artykuł podziel się z innymi udostępniając go w mediach społecznościowych - poniżej
masz
szybkie linki do udostępnień.

 POPRZEDNI ARTYKUŁ
POPRZEDNI ARTYKUŁ NASTEPNY ARTYKUŁ
NASTEPNY ARTYKUŁ 


















